L'effet bystander
induit par les rayonnements Oleg V. Belyakov
traduit de http://belyakov.fortunecity.net/bystander.html
avec l'aimable autorisation de l'auteur
L'effet
bystander induit par les rayonnements est un phénomène par lequel des dommages
cellulaires (échanges de chromatides soeurs, aberrations chromosomiques, apoptose, micronucléation, transformation, mutations et expression de gène) sont
exprimés dans des cellules voisines non irradiées à proximité d'une
cellule ou de cellules irradiées (voir la figure 1). 
figure 1. schéma de l'effet bystander  cellule
directement endommagée cellule
directement endommagée  cellule endommagée par effet bystander
cellule endommagée par effet bystander
Jusque
récemment on a, de façon générale, admis que les conséquences
biologiques suivant l'exposition aux rayonnements sont attribuables aux dommages
à l'ADN. Selon ce paradigme, les dommages à l'ADN se produisent
pendant ou très peu de temps après l'irradiation des noyaux des cellules visées
et le potentiel pour des conséquences biologiques peut être exprimé dans les limites
de une ou deux générations de cellules (Grosovsky, 1999). Quelques éléments
probants ont maintenant émergé qui remettent en cause les effets classiques résultant
des dommages ciblés à l'ADN. Ces effets sont également nommés "non-ciblés" et incluent des effets de proximité, ou "effets
bystander", instabilité génomique induite par la radiation, hypersensibilité aux faibles
doses et induction des gènes par rayonnement (Ward, 1999). La caractéristique
principale des effets "non-ciblés"
est leur survenue particulière à de faibles doses.
Ces
dernières années, quelques équipes ont démontré l'existence d'un effet
bystander dans lequel des dommages sont exprimés dans les cellules voisines non
irradiées à proximité d'une cellule ou de cellules irradiées (Nagasawa
et Little, 1992 ; Hickman et coll, 1994 ; Deshpande et coll, 1996
; Prise et coll, 1998). Dans les expériences pilotes sur l'effet bystander
par Nagasawa et Little (Nagasawa et Little, 1992) des cultures de cellules ont
été exposées à un flux très bas de particules d'alpha, tel que seulement
1% des cellules ont été traversées. Cela a eu comme conséquence une augmentation
des échanges de chromatides soeurs pour 30% à 50% des cellules de la
population. Un article récent (Zhou et coll, 2000) a démontré que les cellules,
irradiées un microfaisceau
précis de particules alpha , pouvaient induire un effet mutagène
de proximité dans les cellules voisines non directement traversées et que
le processus de communication de cellule à cellule à un rôle critique
dans la médiation de l'effet bystander. On a montré que l'irradiation,
avec 20 particules alpha pour chacune, de 20% de cellules hybrides humain-hamster A(L) aléatoirement choisies , a comme conséquence
une fraction de mutants qui est 3 fois plus élevée que prévue, sans effet de modulation.
L'analyse par PCR
a démontré que les types de mutants induits sont sensiblement différents de ceux
d'origine spontanée.
Le mécanisme
de l'effet bystander n'est pas encore connu. Cependant, il y a des preuves que
l'effet bystander peut avoir au moins deux voies différentes pour le transfert
des dommages des cellules irradiées aux voisines non irradiées : par les jonctions
de cellule à cellule (gap junctions) ou par des facteurs de culture.
Azzam et ses collaborateurs (Azzam et coll, 1998)
ont démontré que l'effet bystander dépend de la communication intercellulaire
(gap junctions) dans les cultures confluentes de fibroblastes diploïdes humains
exposés à des flux bas d'irradiation alpha. Ils ont prouvé que les voies métaboliques
p53 et p21 sont activées. Hickman
et ses collègues ont signalé qu'une voie à médiation p53
pouvait être activée dans l'effet bysander (Hickman et autres, 1994). Ils
ont étudié les effets de l'irradiation à faible dose de particules d'alpha
sur cellules épithéliales de poumon de rat. L'analyse cytométrique de la fraction des cellules avec un niveau élevé de
protéine p53
a détecté dans cette fraction une expression accrue par rapport à celles
qui avaient été été frappées par une particule d'alpha.
Le deuxième mécanisme de l'effet bystander
proposé est la médiation de l'effet par la sécrétion de facteurs dans le milieu
de culture (Mothersill et Seymour, 1997 ; Cummins et coll, 1999). Une série
d'études (Lehnert et Goodwin, 1997a ; Lehnert
et Goodwin, 1997b ; Narayanan et coll, 1997) suggèrent un mécanisme alternatif
dans lequel les cellules irradiées sécrètent des cytokines ou d'autres facteurs qui agissent pour augmenter les
taux intracellulaires de formes réactives d'oxygène dans les cellules non irradiées.
Lehnert et collègues ont démontré que le milieu de culture
issu de cellules irradiées avec des flux bas de particules alpha peut induire une augmentation des échanges de chromatides soeurs lorsqu'il est utilisé pour incuber des
cellules non irradiées de test. Mothersill et Seymour (1998) ont rapporté des
données qui suggèrent que l'effet bystander ne dépend pas de la communication
par les gap junctions de cellules en contact.
Il
n'y a pas encore assez d'information disponible pour spéculer au sujet
de la nature des initiateurs de l'effet bystander. Narayanan et les collègues
(1997) ont montré que des facteurs issus du milieu de culture de cellules
irradiées peuvent induire une augmentation des taux intracellulaires de
formes réactives de l'oxygène, y compris le superoxyde et le peroxyde d'hydrogène.
Ils pourraient jouer un rôle important dans le phénomène de transfert
des dommages. D'un autre côté, l'élimination de l'effet bystander
par le traitement thermique du milieu de culture ou par le traitement des cellules
irradiées avec des inhibiteurs de la synthèse des protéines suggère que les facteurs
sécrétés pourraient être des protéines (Lehnert et Goodwin, 1997b).
L'instabilité
génomique et l'effet bystander sont les deux effets non-ciblés de l'irradiation. Ils ont un rayon d'action beaucoup plus grand que
le noyau. L'instabilité génomique induite par le rayonnement est définie
comme une élévation persistante dans le taux d'apparition de
novo de changements génétiques (mutations, aberrations chromosomiques et
micronuclei)
chez une population clonale (Little et coll, 1997 ; Ullrich et Ponnaiya, 1998). Il n'y a jusqu'ici aucune preuve que l'effet
bystander persiste sur beaucoup de générations. Par ailleurs, on a rapporté (le
Comité sur les effets biologiques des radiations ionisantes, 1990) que l'instabilité
génomique persistante
peut être induite par l'intermédiaire d'un effet bystander. Un autre article (Lorimore
et coll, 1998) a démontré l'instabilité chromosomique dans les descendants
clonaux des cellules souches hématopoïétiques après irradiation
de la moelle des os chez la souris avec des particules alpha. Les auteurs ont
étudié les effets d'interposition d'une grille entre les cellules et la source
de particules alpha de sorte que la population survivante consiste principalement
en cellules
souches non atteintes. On a montré que le nombre de cellules clonogéniques transmettant l'instabilité chromosomique était plus
grand que le nombre prévu de cellules devant être atteintes et survivre.
Ce fait suggère que la section initiale de dommages est augmentée par l'effet
bystander, et que les cellules affectées par l'effet bystander peuvent entrainer
un risque accru de changement génétique pour beaucoup de générations.
L'effet bystander ne montre pas un rapport linéaire
avec la dose (Nagasawa et Little, 1992 ; Hickman et coll, 1994 ; Deshpande
et coll, 1996 ; Lehnert et Goodwin,
1997a ; Prise et coll, 1998). Il est induit au maximum par les doses très
basses, suggérant pour son activation un mécanisme avec effet de commutation
(voir le schéma 2). 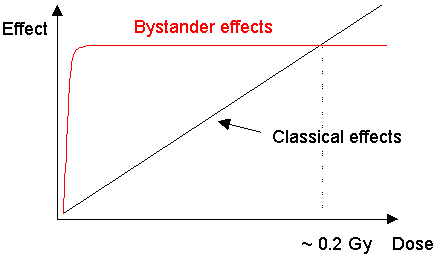
figure 2. Comparaison des types "classiques"
et "bystander" de réponse à l'irradiation L'effet
bystander contribue à une proportion significative de l'ensemble des mutations
dans la région des faibles doses par un mécanisme apparemment
distinct de la réponse "classique" au rayonnement. L'irradiation de
1 fibroblaste avec 1 particule 3He2+ donne lieu à une
augmentation significative de cellules endommagées par effet bystander de approximativement
de 1% à 3%. Un accroissement ultérieur de dose ne change pas la réponse pour une
dose donnée. (Prise et coll, 1998). En raison des différences dans
la fonction dose-réponse, la voie bystander pour
la mutagenèse peut être négligée au delà doses
qui, paradoxalement, sont souvent utilisées comme point de départ
pour l'extrapolation des risques liés aux faibles doses Quelle
est la contribution relative des effets "classiques" et "bystander"
à la mort de cellules ?
Seymour et Mothersill
(Seymour et Mothersill, 2000) ont employé les kératinocytes humains pour étudier le phénomène. Ils
ont présenté des données montrant une méthode pour corriger la courbe globale
de survie permettant l'analyse des contributions relatives de l'effet bystander
et de l'effet attribuable à l'interaction directe du rayonnement avec la cellule
cible. La technique utilisée est de construire une courbe clonogénique de survie en utilisant l'analyse de Puck et de Marcus. Les résultats de survie sont convertis en mort clonogéniques pour l'effet bystander et pour l'effet total. Par
soustraction, on peut déterminer le % de cellules mortes non induites par
effet bystander. Les données prouvent que pour cette lignée humaine de
cellules épithéliales, les doses de 0.01 à 0.5 Gy
de rayons gamma induisent seulement la mort clonogénique par l'effet bystander (voir la figure 3). |


